Jennifer Doudna, una de las pioneras de la edición genética, se había preparado mentalmente para cuando llegara el día, abriera su correo o respondiera una llamada anunciando el primer bebé editado con la técnica CRISPR.
Ese día llegó. Y fue anunciado a finales de noviembre por su inspirador, el chino He Jiankui: editó un gen en un par de mellizas, Lulu y Nada, para disminuir el riesgo de que contrajeran el VIH.
El momento se veía llegar desde que en 2015 otros chinos editaran genes (modificaran) en embriones humanos para corregir un trastorno sanguíneo, la beta talasemia. No fue un intento exitoso, aunque la intención era interrumpir el desarrollo embrionario a los tres días.
Y en 2016 un equipo encabezado por Canquan Zhou y Junjiu Huang usó la técnica para remover en embriones una variante genética relacionada con cardiomiopatía hipertrófica. Tras tener éxito, a los tres días interrumpieron su crecimiento.
Aunque se considera tal vez la técnica más prometedora para editar el ADN de las personas y aliviar enfermedades y defectos o prevenirlos, las llamadas tijeras genéticas, como también se les conoce, permiten la selección de rasgos de los seres vivos. Es decir, en el caso humano, bebés a la carta según la voluntad de sus padres: de ojos claros u oscuros, cabello rubio o negro, altos o bajos y así por el estilo.
Por eso los científicos en general han mantenido un acuerdo explícito: no crear bebés diseñados más que para corregir problemas y solo cuando la técnica sea segura. Aún no lo es.
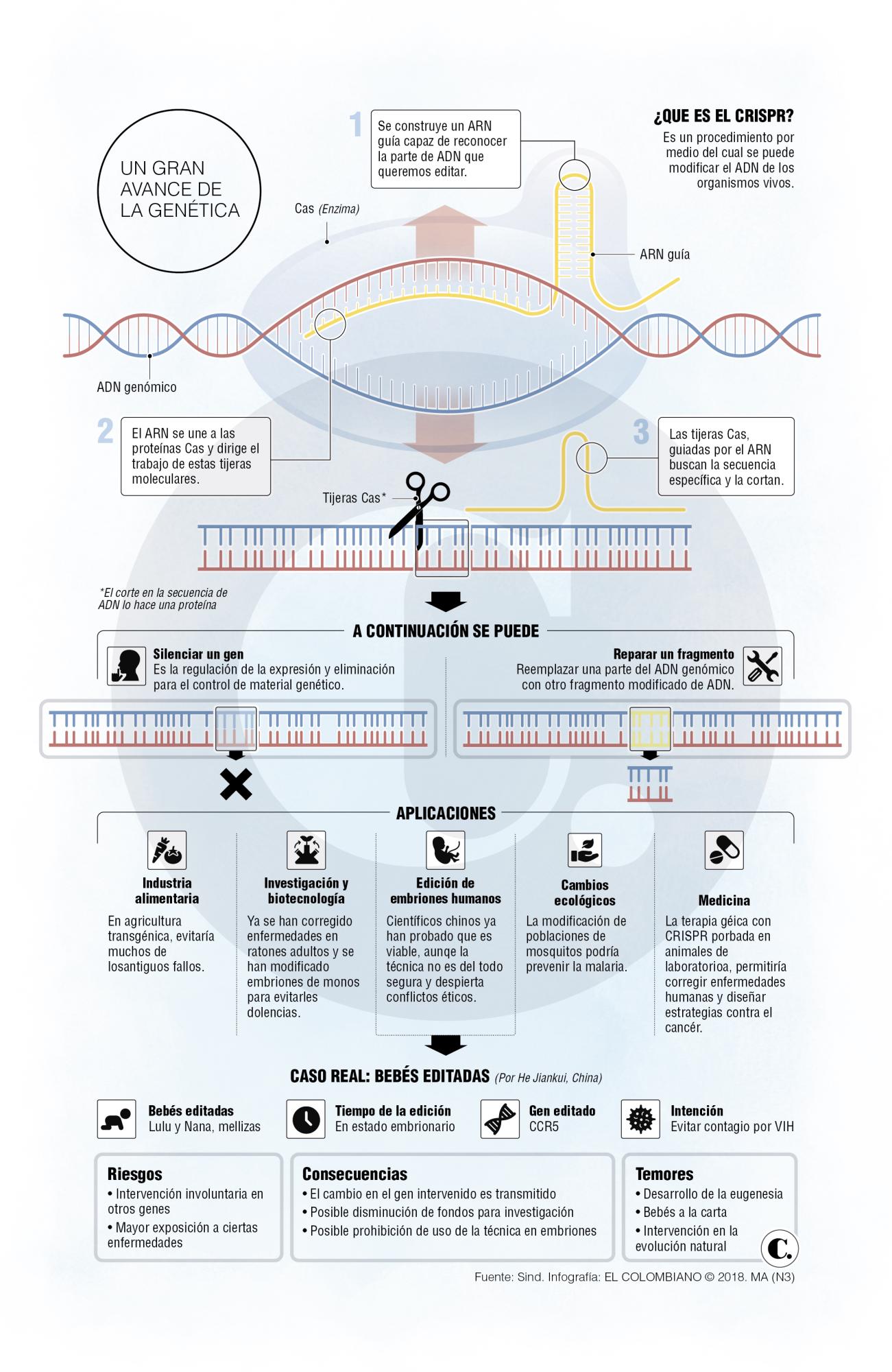
He Jiankui editó el par de mellizas in vitro y una de ellas solo quedó con una copia anulada del gen CCR5.
Del caso el científico no reveló toda la información.
Aparte del revuelo, el anuncio se dio dos días antes del Segundo Encuentro Internacional sobre la Edición del Genoma Humano en Hong Kong, en el que investigadores del tema de distintos países acordarían cómo continuar las investigaciones.
A diferencia de otros avances genéticos, la modificación de las células germinales (células diferenciadas) se transmite a los hijos: se altera la herencia y la evolución.
“Nunca hemos hecho algo que cambiara los genes de la raza humana y nunca hemos hecho algo que tenga efectos que pasen por generaciones”, en palabras de David Baltimore, quien presidió la reunión internacional. He y sus colaboradores lo hicieron.
Para ello limpiaron el esperma de hombres para que no tuvieran el VIH, luego lo inyectaron, con las enzimas de CRISOR-Cas9 (gráfico) en óvulos no fertilizados de las parejas de aquellos. Produjeron 22 embriones de los cuales 16 parecían viables para ser editados. Dos de cuatro de una pareja contenían modificaciones del CCR5 y He los implantó en la mujer, aunque uno tenía una copia intacta de ese gen.
¿Para qué todo eso?
Las personas sin las copias del gen pueden ser inmunes al VIH.
Hay otras formas más fáciles y menos caras de prevenir esa infección. Paula Cannon, de la Universidad del Sur de California, recuerda que existen otros mecanismos por los cuales el virus puede ingresar a la célula, como la proteína CXCR4, así la persona no posea las formas activas del CCR5.
Es más, la bioética Tetsuya Ishii, de la Universidad de Hokkaido en Sapporo, Japón, cuenta que los bebés de mujeres con VIH pueden nacer por cesárea para evitar la transmisión durante el parto. Para ajustar, en un video He Jiankui dice que el padre de las mellizas es positivo al virus, la madre no.
En el estado actual de los estudios persiste el riesgo de que se introduzcan mutaciones no deseadas o nazca un bebé con unas células modificadas y otras no, un mosaico con consecuencias difíciles de predecir.
Incluso la universidad a la cual pertenece el investigador, Southern University of Science and Technology, en Shenzhen, anunció una investigación sobre el caso pues no se cumplieron los estándares académicos y éticos.
Para algunos, como George Daley, decano de Medicina de Harvard, hay otras enfermedades que merecen más atención para tratar con la edición genética que el VIH, como la enfermedad de Huntington (que afecta las neuronas y la parte mental).
El investigador chino fue invitado al encuentro internacional, donde reveló algunos detalles y defendió su trabajo. No convenció a todos. Alta Charo, de la Universidad de Wisconsin considera, tras escucharlo, que el caso “no fue bien hecho, fue prematuro, innecesario e inútil”.
Avanzar con calma
Hoy es prohibido en muchas regiones, como Estados Unidos, China y parte de Europa, generar un embarazo con un embrión modificado genéticamente, si bien instituciones como la Academia Nacional de Ciencias estadounidense han insinuado proseguir con los avances en la edición genética de bebés, pero solo si se logra con seguridad y bajo estricta supervisión.
El trabajo de He ha activado los temores de la comunidad científica de que se impongan serias trabas gubernamentales a la investigación.
De ese parecer es Fyodor Urnov, de un instituto sin ánimo de lucro en Estados Unidos, pues el caso de las mellizas podría hacer retroceder una década de progreso al generar reacciones adversas en el público frente a la edición de células germinales.
Scott Gottlieb, comisionado de la Administración de Alimentos y Medicinas (FDA), considera que “los gobiernos tienen que reaccionar”.
En un pronunciamiento de Francis Collins, director de los Institutos Nacionales de Salud de EE. UU., pide “el desarrollo de un consenso internacional vinculante que establezca límites a esta clase de investigaciones nunca ha sido más claro”. Por eso no apoya esta tecnología para uso en los embriones humanos.
Pese a todas estas inquietudes, el encuentro en Hong Kong declaró al final que “la edición de células germinales del genoma podría ser aceptable en el futuro si los riesgos son resueltos”.
Joyce Harper, de University College London en el Reino Unido, especialista en salud reproductiva de la mujer, cree que “se requieren años de investigación para mostrar que intervenir el genoma de embriones no va a provocar ningún daño”.
Lo que dice la gente
Para respaldar su trabajo, He contrató un experto en relaciones públicas. Y en una encuesta de opinión, de la Universidad Sun Yet-Sen, con 4.700 chinos, más de 60 % favorecía la edición en niños si el objetivo era tratar o prevenir una enfermedad.
Una encuesta similar, del Centro Pew en Estados Unidos, tuvo en el pasado resultados similares por parte de los estadounidenses.
De todo esto queda claro que la ciencia no está preparada todavía para la edición de embriones. Hoy adelanta estudios con niños y adultos.
Hace dos años un grupo chino reportó ser el primer en usar CRISPR en un humano. Y en Estados Unidos un grupo recluta hoy personas para ayudar a pacientes con cáncer al remover sus células T y hacerlas así más efectivas en la lucha contra la enfermedad, y luego reintroducirlas en los pacientes.
¿Qué hay qué hacer?
Al final del encuentro en Hong Kong, la declaración sugiere que las academias de ciencia alrededor del mundo deben hacer recomendaciones a sus gobiernos. Y pide la creación de un foro internacional que registre las investigaciones y ensayos clínicos, buscando además la equidad en el acceso a la técnica.
Algunas voces recomiendan, además, alertar a las autoridades cuando se sepa que un científico esté editando embriones.
El debate queda abierto. El mejoramiento de CRISPR avanza y habrá “usos malos” (bebés a la carta), como en cualquier tecnología nueva, dice Neuhausser, recordando que el potencial es alto.
Y también los riesgos
Fuentes: MIT Technology Review, Nature, NIH, Scientific American, Smithsonian Institute, The Atlantic, The Scientist, Universidad de California en Berkeley..
















 Regístrate al newsletter
Regístrate al newsletter